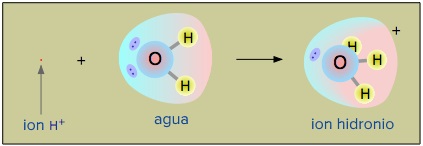
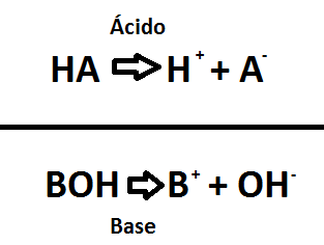
_/Rk Ácidos y bases Definiciones ácidobase endobj > ÁCIDOS Y BASES Según la teoría de Arrhenius, ácido es toda sustancia capaz de dar iones hidrógeno (H) como uno de sus productos iónicos de disociación en agua HA(ac) H (ac) A (ac) El ion H, denominado protón o hidrogenión, se encuentra hidratado en solución acuosa, pero alStart studying Tema 4 Equilibrio ÁcidoBase Learn vocabulary, terms, and more with flashcards, games, and other study toolsMolécula o ion que se forma cuando una base gana un ion de hidrógeno Base conjugada Ion o molecula que se forma cuando un ácido gana un ion de hidrogeno Par ácidobase conjugado Dos pines o moléculas que se relacionan entre sí por la pérdida o ganancia de un hidrógeno

Acidos Y Bases Arrhenius Bronsted Lowry Electrolitos Sabor Tacto Convierte El Papel Tornasol Convierte
Hi es acido o base segun arrhenius
Hi es acido o base segun arrhenius-Ácidos fuertes vs débiles vs bases Varios científicos definen los ácidos de varias formas Arrhenius define un ácido como una sustancia que dona H 3 O iones en la solución, mientras que la base es una sustancia que dona OH – iones a la solución BronstedLowry define un ácido como una sustancia que puede donar un protón y una base como una sustancia que puede aceptar unÁCIDOS Y BASES CUARTO MEDIO ITeniendo en cuenta la teoría de Arrehnius,y la teoría de Lewis identifica cuáles de estos compuestos son ácidos de arrhenius y de Lewis y cuáles son bases de arrhenius y de lewis a) HI b)Zn(OH)2 a) Al(OH)3 b) HNO3 c) SO42 d) H2S e) NH4 II Colocar cuando corresponda ácido, base, ácido conjugado, base




Pin En Chemistry
12 juliorentobles Respuesta clasifica una sustancia como un ácido si produce iones hidrógeno H () o iones hidronio H3O () en agua Una sustancia se clasificará como una base si produce iones hidróxido OH () en agua A kattyahto8 y otros 19 usuarios les ha parecido útil esta respuesta heart outlined• Según la teoría de BronstedLowry, una base es un aceptor de protones Según la teoría de Arrhenius, una base es un donante de iones hidróxido • La teoría de Arrhenius no explica por qué algunas sustancias como el bicarbonato de sodio pueden actuar como bases• Un ácido es una sustancia que, cuando se disuelve en agua, aumenta la concentración de iones H • Una base es una sustancia que, cuando se disuelve en agua, aumenta la concentración de iones OH Concepto de ácido base según Arrhenius El concepto de Arrhenius sobre los ácidos y las bases, aunque es útil, tiene limitaciones Una de ellas es que está restringido a las
Teoría ÁcidoBase de Arrhenius El concepto de ácidobase de Arrhenius clasifica una sustancia como un ácido si produce iones hidrógeno H() o iones hidronio H 3 O() en agua Una sustancia se clasificará como una base si produce iones hidróxido OH() en agua Esta manera de definir los ácidos y las bases funciona bien para las soluciones acuosas, pero las propiedades de ácido y dePresencia de un ácido o una base) Tabla 12 Comportamiento de ácidos y bases Comportamiento Acido Citrico, agrio Reacciona con algunos metales, desprendiendo hidrógeno gaseoso No presenta No cambia el color de la fenolftaleina (incoloro) Comportamiento Base Amarg o No reacciona con algunos metales Si presenta Cambia el color de laAnswer (1 of 2) My word An \text{Arrhenius base} is a species that increases the concentration of the hydroxide in waterand ammonium participates in the following equilibrium to give hydroxide, and ammonium ion NH_{3}(aq) H_{2}O(l) \rightleftharpoons NH_{4}^{} HO^{} Given starting co
La teor de Arrhenius ha sido objeto de críticas La rimera es que el con pto de ácidos se imita a especies quí icas que contienen hi ógeno y el de base a las especies que co tienen ior=s hidroxil La segunda crítica es que la teoría sólo acuosas, cuando en realidad se conocen muchas reacciones ácidobase que tienen lugar en ausencia de aguaQuimica Ejercicios Resueltos Reacciones Acido Base Preview Full text 7 Reacciones ácidobase 1 Indica y justifica la falsedad o veracidad de las siguientes frases a) Según Arrhenius, una base debe originar iones OH al disolverla en agua b) Según BrönstedLowry, para que un ácido pueda ceder protones no es necesaria la presencia de Una base de Lewis, entonces, es cualquier especie que tenga un orbital lleno que contenga un par de electrones que no esté involucrado en la unión, pero puede formar un enlace dativo con un ácido de Lewis para formar un aducto de Lewis Por ejemplo, el NH3 es una base de Lewis, ya que puede donar su par de electrones




Semana 12 Acidos Bases Y Electrolitos Acidus Latn




Acidos Y Bases Arrhenius Bronsted Lowry Electrolitos Sabor Tacto Convierte El Papel Tornasol Convierte
Tema 6 Conceptos AcidoBase 61 Conceptos AcidoBase 12 Lux y Flood Basa el comportamiento ácidobase en términos del ión óxido Es el primero que sirve para sistemas no próticos, Pj Fusiones inorgánicas a alta temperatura Acido es un aceptor de grupos óxido Base es un dador de grupos óxido CaO SiO 2 CaSiO 3 Base dador AcidoCada base se hace reaccionar con agua y la reacción de mayor K (mayor extensión) da cuenta de la base más fuerte Base 1 H2O (l) = OH (ac) ácido 1 KBase 1 Base 2 H2O (l) = OH (ac) ácido 2 KBase 2 Si KBase 1 > KBase 2 entonces Base 1 más fuerte que Base 2Las bases deben tener un OH en su molécula;




Fisica Quimica Ejercicios Resueltos Acidos Y Bases Bronsted Lowry




Acidos Y Bases Ppt Descargar
Si dona un protón a) La base conjugada es (CO3)2 b) La base conjugada es (CO2)2 c) La base conjugada es (CO3) d) No tiene bases conjugadas 52 13 Pares conjugados ácidobase Con respecto a cada ácido o base, indica la base o ácido conjugado que se solicitaCientíficos como Svante Arrhenius, Johannes Niclaus Bronsted, Thomas M Lowry y Gilbert N Lewis contribuyeron enormemente en lo que es la teoría de los ácidos y bases en las cuales a través del tiempo se han dado cuenta de muchas cosas, gracias a los experimentos de laboratorios que hacían con la ayuda de un papel llamado papel tornasolácido 1 base 2 base 1 ácido 2 el ácido 1 y la base 1 forman lo que se denomina un par ácido ‑ base conjugado, (al igual que el ácido 2 y la base 2) Según esta definición, en la reacción HCl NH 3 à Cl NH 4 el amoniaco es una base ya que tiende a




Pin En Chemistry



Todos Los Acidos De Arrhenius Son Acidos De Bronsted Pero Todas Las Bases De Arrhenius No Son Bases De Bronsted Por Que Quora
Los ácidos deben tener un H en su molécula; El (HCO3) actúa como ácido ¿Cuál es su base conjugada?Una base es toda sustancia que puede ceder un par de electrones para formar un enlace covalente coordinado Esta definición incluye a los ácidos y bases de las teorías de Arrhenius y BronstedLowry, además de otras reacciones que tienen lugar en medio no acuoso y




8 Reacciones Acido Base Fqjmramirez




Semana 12 Acidos Bases Y Electrolitos Quimica Ppt Descargar
ACIDO BASE 1 Reacciones de transferencia de protones Reacciones ácidobase 2 Ácidos y bases • ÁCIDOS • sabor ácido • enrojecen la tintura o papel azul de tornasol • disuelven el mármol • reaccionan con metales desprenden H2 • neutralizan a las bases • BASES • sabor amargo • azulean el papel o la tintura de tornasol enrojecida • sensación jabonosa al tactoPor lo tanto, esta teoría no puede explicar por qué el NH 3 o el Na 2 CO 3 son bases Otras Teorías sobre Ácidos y BasesNh3 acido o base arrhenius Marzo 22, 21 315 am




Reaccion Acido Base Wikipedia La Enciclopedia Libre




Semana 12 Cidos Bases Y Electrolitos Qumica 19
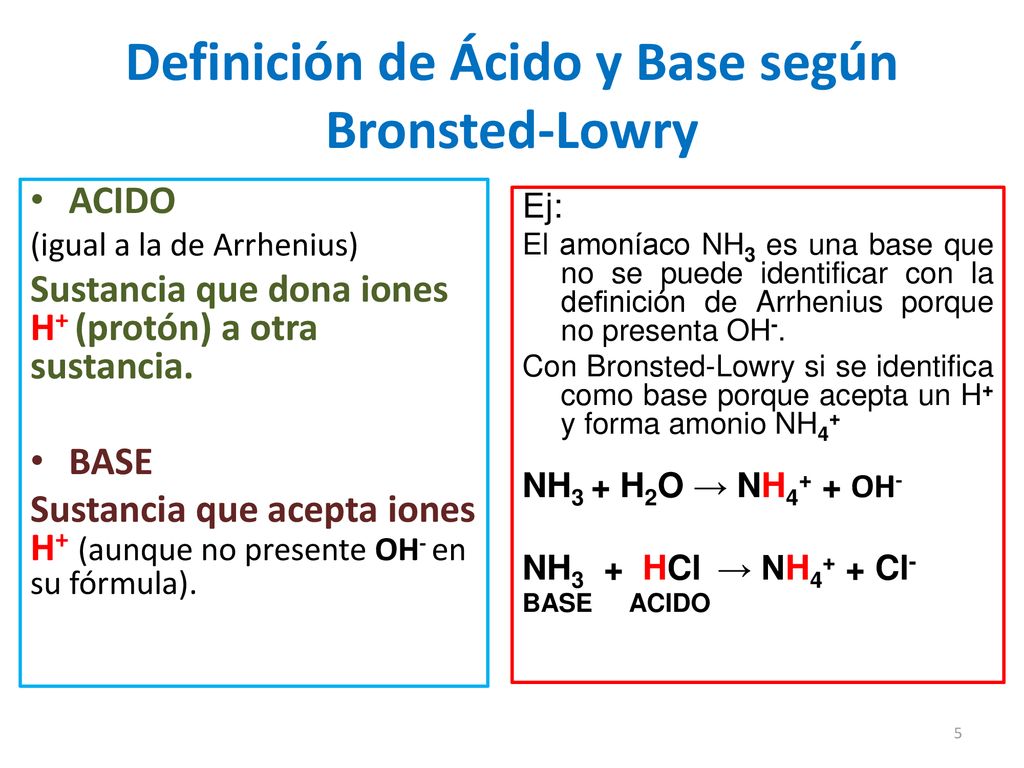
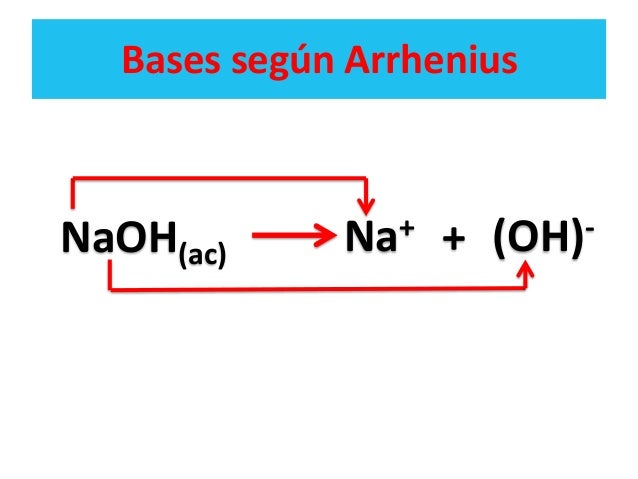
Base Sustancia capaz de aceptar un ión hidrógeno Definición BronstedLowry Ión hidroxilo La teoría de Brönsted y Lowry para ácidos y bases incluye a la de Arrhenius y la amplía 10 Un ácido Brønsted es un donador de protón (H ) Una base Brønsted es un aceptador de protón (H ) ácido base conjugada base ácido conjugado 11Los ácidos de Arrhenius La teoría de ácidos y bases de Arrhenius fue propuesta originalmente por el químico sueco Svante Arrhenius en 14, quien sugirió clasificar ciertos compuestos como ácidos o bases de acuerdo con el tipo de iones que se forman cuando el compuesto se añade al agua Fotografía de dos toronjas rojo rubí, una0,012 x x Como el HCl es un ácido fuerte y la solución no es muy diluida, el aporte de iones hidrónio por parte del agua, es muy pequeño comparado con el aporte del ácido, es decir 0,012 x " 0,012, luego la concentración total de protones es aportada sólo por el




Ejer Resueltos2 Catedu
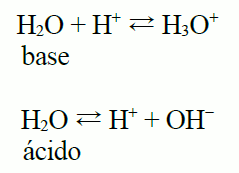



6 Reacciones Acido Base
HF H 2 O ←→F H 3 O , K a 3,5 10 5 0,5 x 0 x x La solución es x 0,013 Por tanto, el grado de disociación es α 0, x 50 0,026 y pH –log(0,013) 1, d) Se hace lo mismo que en el anterior apartado es un ácido débil Hay que consiTienen lugar en una extensión despreciable, ya que el ión Cl − es una base muy débil (su ácido conjugado es muy fuerte) y el catión Na(H 2 O) n es un ácido muy débil En consecuencia, el pH de la disolución no se modifica por las reacciones anteriores y es el mismo que el del agua pura, es decir, 7, a 25ºC Limitaciones de la Teoría de Arrhenius La descripción de ácidos y bases de Arrhenius solo es válida para Disoluciones acuosas Los ácidos deben tener un H en su molécula Las bases deben tener un OH en su molécula Por lo tanto, esta teoría no puede explicar por qué el NH3 o el Na2CO3 son bases




Acidos Y Bases Capitulo Ppt Descargar



2
Según Arrhenius, NH 3 no es una base, sin embargo, para BrønstedLowry sí lo es Reacción directa Cuando NH 3 se disuelve en H 2 O, el NH 3 acepta un ion H (definición de base según BL) Se forma NH 4 Por esta razón, NH 3 es considerado una base según BrønstedLowry En la reacción inversa El NH 4 cede un H para formar NH 3Varios científicos definen los ácidos de varias formas Arrhenius define un ácido como una sustancia que dona H 3 O iones en la solución BronstedLowry define una base como una sustancia que puede aceptar un protón La definición de ácido de Lewis es mucho más común que las dos anteriores Explicación El concepto de ácidobase de Arrhenius clasifica una sustancia como un ácido si produce iones hidrógeno H () o iones hidronio H3O () en agua Esta manera de definir los ácidos y las bases funciona bien para las soluciones acuosas, pero las propiedades de ácido y de base se observan en otros entornos




2 1 Acidos Y Bases De Bronsted Y Lowry Organicos Qoi 14 I Chocoteco Renteria Madai




Acidos Y Bases Arrhenius Bronsted Lowry Electrolitos Sabor Tacto Convierte El Papel Tornasol Convierte
Reacciones de transferencia de protones s a arrhenius (1859 1927)Limitaciones de la Teoría de Arrhenius La descripción de ácidos y bases de Arrhenius solo es válida para Disoluciones acuosas;Cuál es la diferencia entre Bronsted Lowry y Arrhenius?




Teorias Acido Base De Lewis Y Bronsted Lowry Docsity




Acidos Y Bases De Bronsted Lowry Articulo Khan Academy
Acido es un donador de protones (H) Bases liberan iones hidróxido (OH) en agua Base es un receptor de protones (H) Las bases siempre son hidróxidos El compuesto con más H es el ácido La neutralización, es un ácido más una base produce agua y sal La neutralización es el par conjugado de ácido base Se aplica en solucionesO ÁCIDOS Y BASES 7 Definición de Arrhenius •Esta definición únicamente es aplicable a sistemas cuyo disolvente es agua •Calores de neutralización ΔH neutralización (kJmol1) para varios pares ácidobase •Todas estas reacciones se deben a una especie común en todas las disoluciones 577 584 561 575 576 H 2 O 3/NaOH Las definiciones de Brönsted y Lowry, permite clasificar como bases, algunas sustancias que según Arrhenius no lo eran, como puedan ser NH3, S2, HCO3, CH3HN2, etc De esta manera se ha podido explicar el comportamiento básico del amoniaco (NH3), que aun sin disociarse produciendo grupos OH, es igualmente una base




Ayuda Lo Nesesito Urgente 2 Disocia Cada Una De Las Siguientes Especies Acido Base Aplicando La Brainly Lat
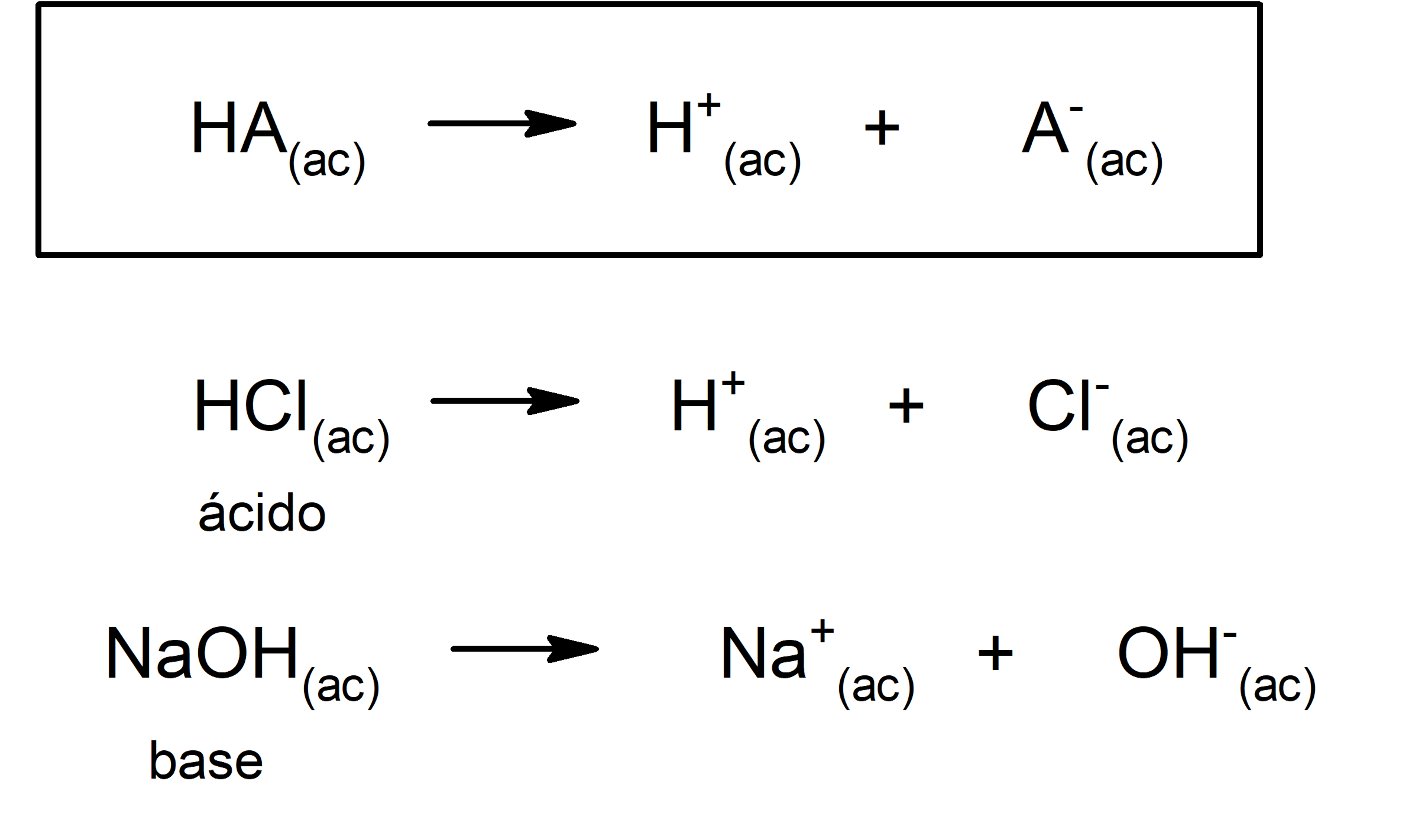



Como Se Forman Los Acidos Bases Y Sales
Efecto nivelador del disolvente Cualquier ácido más fuerte que el ion H 3 O cede un protón al agua para formar H 3 O Por ello, ningún ácido más fuerte que el agua "sobrevivirá" en H 2 O y, por tanto, se desprotonará inmediatamente Por ejemplo, no es posible discernir si el HBr es más o menos fuerte que el HI, pues ambos se disocian totalmente en aguaEl adjetivo básico es sinónimo de alcalino, es decir que una base es un álcali Teoría ácidobase de Arrhenius Svante August Arrhenius publicó en 17 la Teoría de la Disociación Iónica afirmando que algunas sustancias en solución acuosa se disocian en cationes y anionesMoléculas disociadas del ácido o de la base, y se puede expresar en tanto por 1 o en tanto por 100 Cuanto más pequeño sea el grado de disociación, el ácido o la base es más débil, considerándose que 100% ó 1 en los ácidos y bases muy fuertes Este parámetro va a



2




Problema De Acidos Y Bases De Bronsted Lowry 12 Youtube
Cuanto mayor es el valor de K a o K b mayor es la fuerza del ácido o de la base Igualmente, cuanto mayor es el valor de pKa o pKb menor es la fuerza del ácido o de la base Ejemplo Determinar el pH y el pOH de una disolución 0,2 M de NH 3 sabiendo que K b (25ºC) = 1,8 10 –5 M Equilibrio NH 3 H 2O ↔ NH 4 OH –El equilibrio ácidobase en los compuestos orgánicos Teoría de Arrhenius Según la teoría de Arrhenius, desarrollada a finales del siglo XIX, un ácido es una sustancia que se ioniza en disolución acuosa dando iones H (HCl) y una base es una sustancia que se ioniza en disolución acuosa generando aniones hidroxilos (OH)Yodhídrico HI Ác Bromhídrico HBr Ác Clorhídrico HCl Ác Sulfúrico H 2 SO 4 Ác Nítrico HNO según Arrhenius, base es toda especie que en disolución razone si son ácidos o bases las especies (HCO 3)y NH 3 b) Indique cuáles son las bases conjugadas de los ácidos H




Semana 12 Cidos Bases Y Electrolitos Qumica 19




Acido Y Bases Ejercicios Resueltos Pdf Segun Arrhenius Bronsted Lowry Lewis Ph Y Poh
BASE DEBIL § Se ionizan en pequeña proporción y es reversible § Tienen una constante de ionización (Kb) que se encuentra en tablas y se puede calcular así Ej amoníaco NH 3 H 2 O ⇄ NH 4 OHKb = NH 4 OH NH 3 (NO se toma en cuenta el H 2 O en la expresión de Kb ni en Ka) Ejemplo de bases débiles C 6 H 5 NH 2 NH 3 Kb 4Según la Teoría ácidobase de BrønstedLowry, base es toda sustancia capaz de aceptar protones, y ácido es aquella capaz de cederlos Una consecuencia de lo anterior es que existe la reversiblidad de la transferencia de protones, 1 ya que al ceder un protón, un ácido HA, la parte restante A, sería capaz de aceptar este H , o sea, se comportaría como una base, la cual es conocida Segun Arrhenius que es un acido y que es una base 1 Ver respuesta ácido es una sustancia que es capaz de liberar iones de hidrógeno (H) en una solución Una base es una sustancia capaz de disociar iones de hidróxido OH en una solución Brainlycombr FR Nosdevoirsfr TR Eodevcom RO Brainlyro ID Brainlycoid HI Brainly




Acido Y Bases Ejercicios Resueltos Pdf Segun Arrhenius Bronsted Lowry Lewis Ph Y Poh




Acidos Y Bases




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas




1 Ejercicio 1 Acido Base Completar La Reaccion E Indicar Los Acidos Y Bases Conjugados Youtube




1 Cual Es La Diferencia Entre Las Teorias De Acido Y Base De Arrhenius Lewis Bronsted Lowry Brainly Lat




Acido De Arrhenius Definicion Y Ejemplos Estudyando




Acidos Y Bases



2




Teorias Acidos Base Arrhenius Bronsted Lowry Y Lewis Curso Para La Unam



2




Tema 12 Acido Base Apuntes De Quimica Docsity
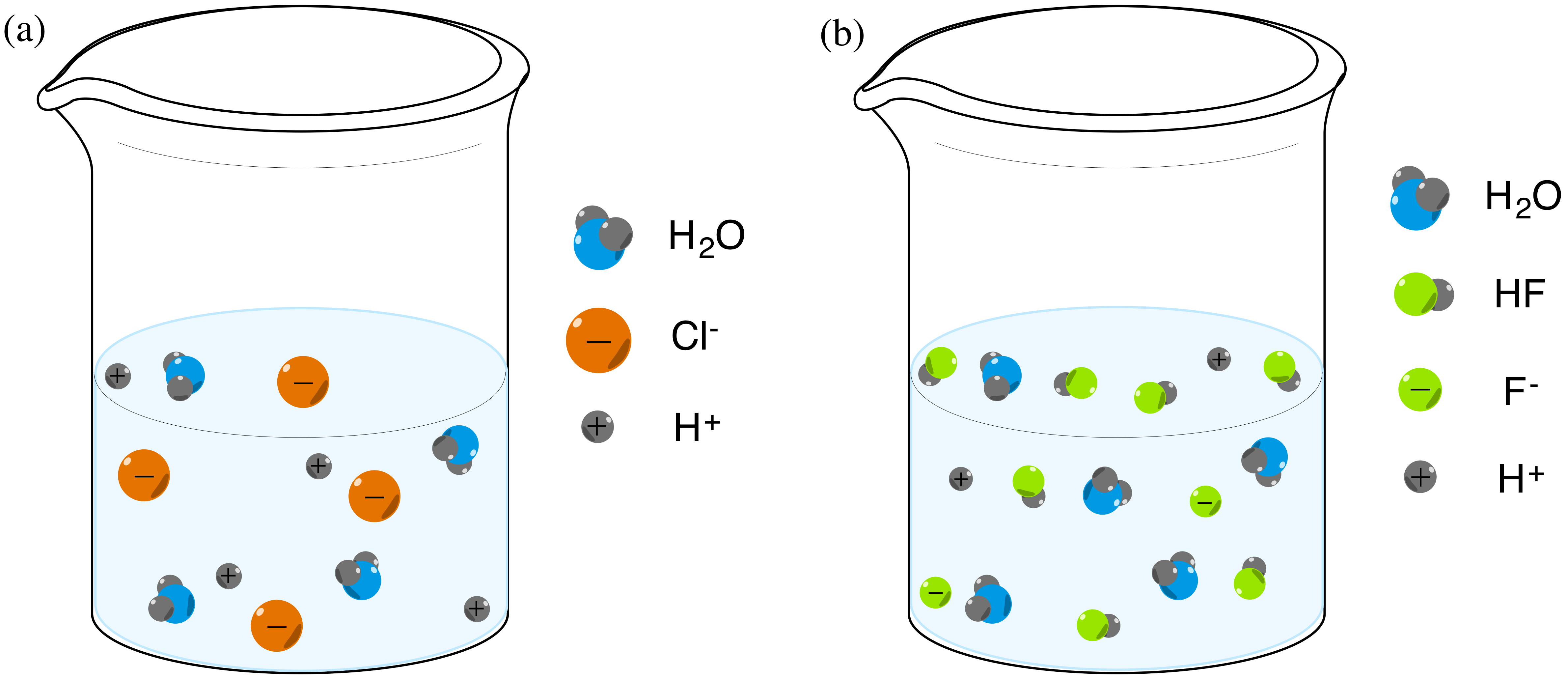



Acidos Y Bases De Bronsted Lowry Articulo Khan Academy




Acidos Y Bases



2




Acido Y Bases Ejercicios Resueltos Pdf Segun Arrhenius Bronsted Lowry Lewis Ph Y Poh




Acidos Y Bases



2




Doc Acido Base Claudia Medina Academia Edu




Teoria Acido Base De Arrhenius Fisicoquimica



Semana 12 Acidos Bases Y Electrolitos Quimica Ppt Descargar




Arrhenius Acids And Bases Article Khan Academy




Semana 12 Cidos Bases Y Electrolitos Qumica 19



Acidos Y Bases De Arrhenius Articulo Khan Academy
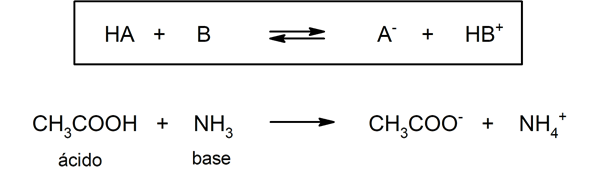



Como Se Forman Los Acidos Bases Y Sales



Teoria De Arrhenius



2




Definicion Acido Base Pdf Acido Fisica Molecular




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas



Propiedades De Acidos Y Bases



100cia Quimica Temario Quimica 2º Bac Tema 8
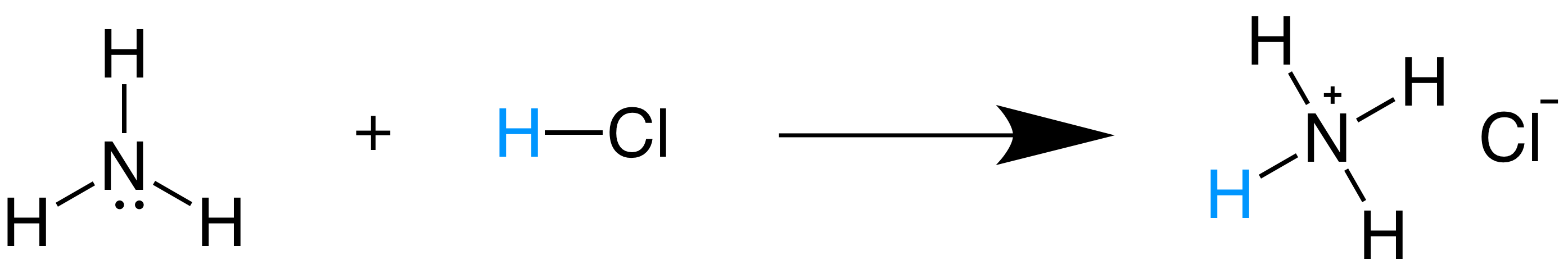



Acidos Y Bases De Bronsted Lowry Articulo Khan Academy




Pin En Chemistry




Quimica 4 Medio Teorias De Acido Base Ppt Video Online Descargar




9 Reacciones Acido Base Pdf Free Download



2



2




Pin En Biologia




Pdf Deficiencias Epistemologicas En La Ensenanza De Las Reacciones Acido Base Y Dificultades De Aprendizaje




Acido Y Base Conjugados Youtube



100cia Quimica Temario Quimica 2º Bac Tema 8




Guia De Laboratorio Nc2b03 Pdf Solucion Tampon Acido




Teoria Acido Base De Arrhenius Fisicoquimica
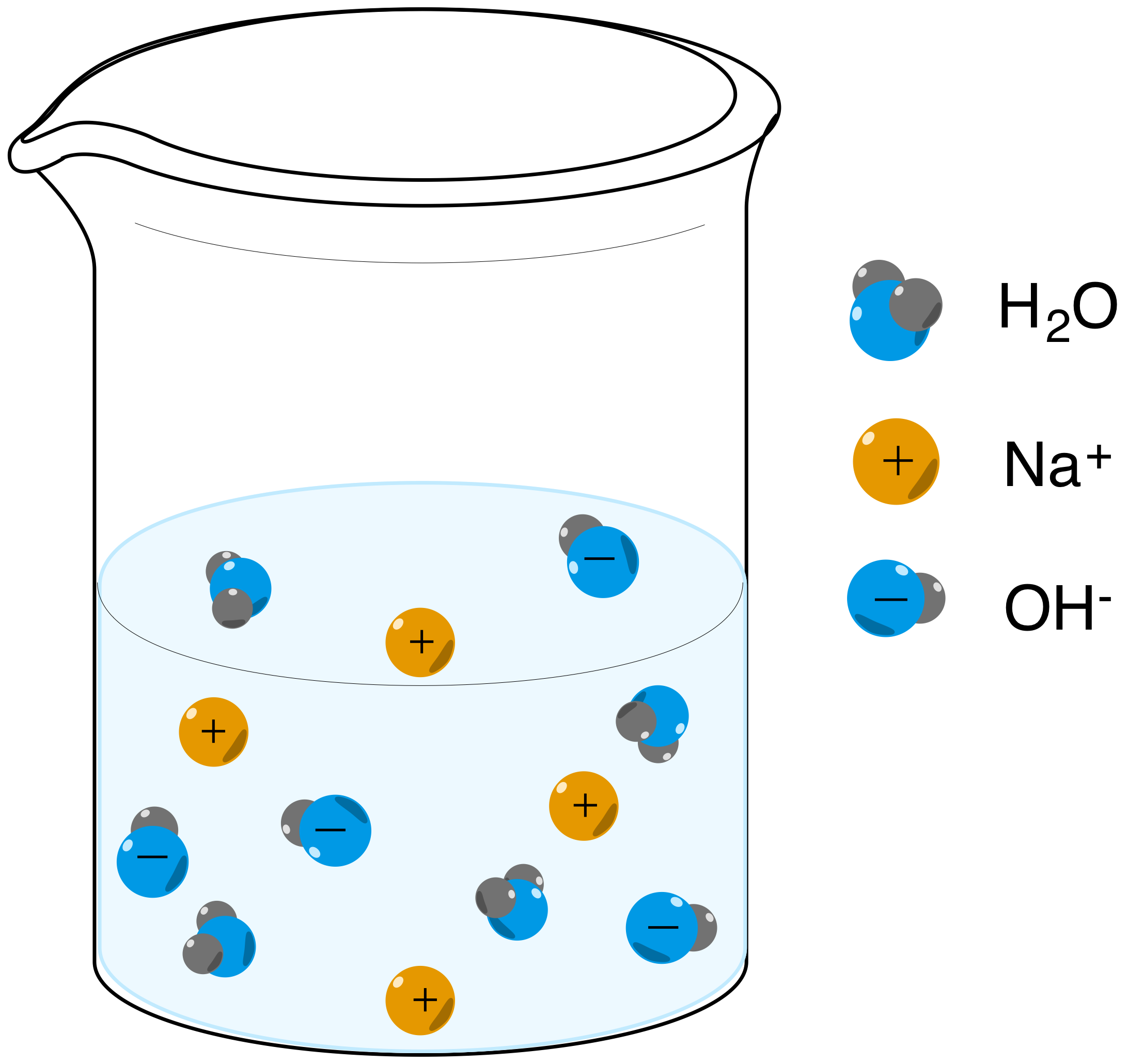



Acidos Y Bases De Arrhenius Articulo Khan Academy




Ejercicios Resueltos Anaya Acidos Y Bases Docsity




Atomo Neutralizacion Acido Base




Teor As Icido Base



Acido




Aicido Base Quimica Basica
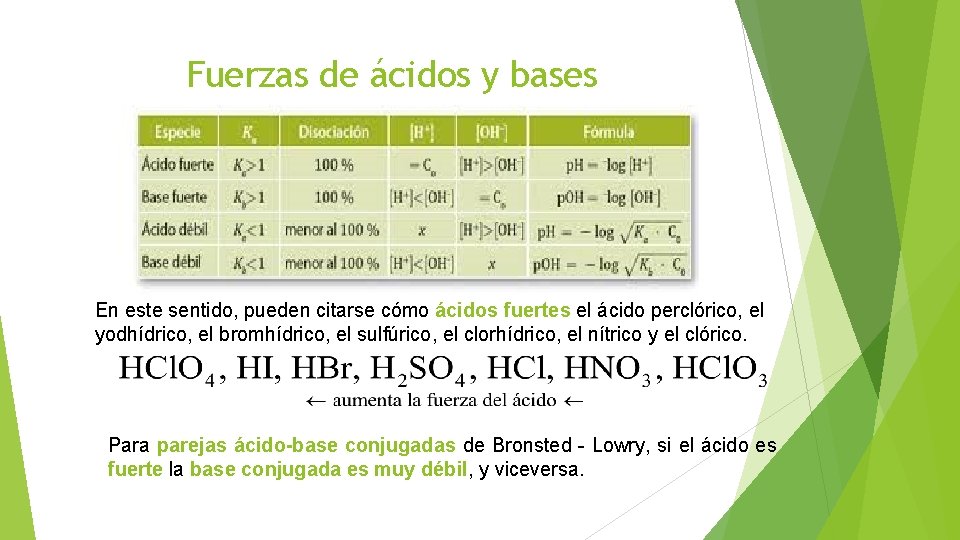



Reacciones De Transferencia Cidobase Profesora Roxana Reinoso Caro




Definicion De Arrhenius Para Acidos Y Bases Youtube




Acido Y Bases Ejercicios Resueltos Pdf Segun Arrhenius Bronsted Lowry Lewis Ph Y Poh



2




Guia Acidos Y Bases




Guia De Apoyo Nº4 Q2 M 13 Reacciones Acido Base




Teoria De Arrhenius De Acidos Y Bases Quimica Wikisabio




Teorias Acido Base Quimica En Casa Com
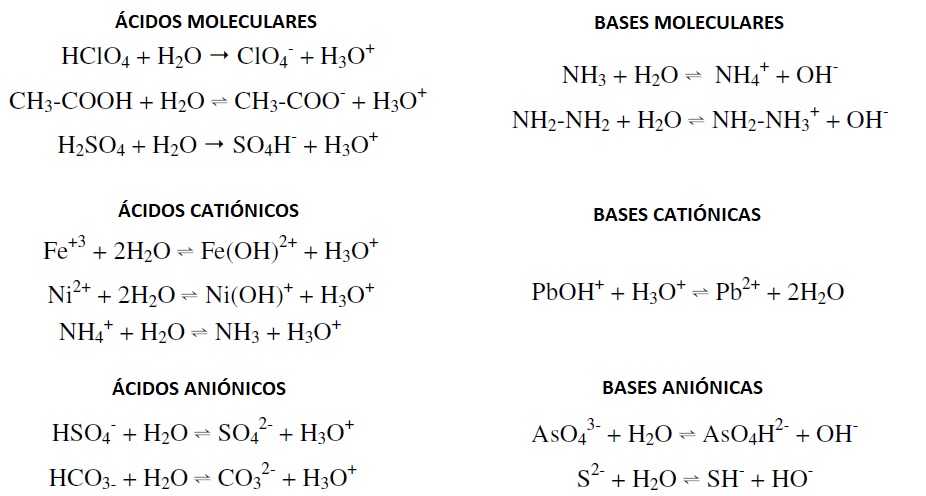



Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas




Inorganica I Tema 1 Apuntes De Quimica Inorganica Docsity
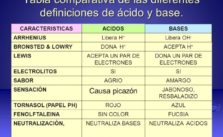



Cuadros Comparativos De Arrhenius Bronsted Lowry Y Lewis Cuadro Comparativo



2




Arrhenius Bronsted Lowry Lewis Ppt Descargar




Teoria De Bronsted Y Lowry De Acidos Y Bases Quimica Wikisabio




Acido Base Acidos Y Bases De Arrhenius Youtube



1




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas



2



2



2



2




Rea Teorias Acido Base



Acido




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas




Teoria De Arrhenius Acido Base Youtube




Equilibrios Acido Base 2ºbachillerato Quimica Cervez Apuntes De Biologia Docsity
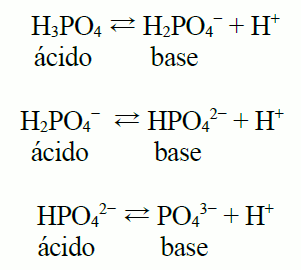



6 Reacciones Acido Base




Teorias Acido Base Quimica En Casa Com




Semana 12 Acidos Bases Y Electrolitos Ppt Video Online Descargar



0 件のコメント:
コメントを投稿